Электродиализные установки
Электродиализ - процесс мембранного разделения, в котором ионы растворенного вещества переносятся через мембрану под действием электрического поля. Движущей силой процесса является градиент электрического потенциала. Под действием электрического поля катионы перемещаются по направлению к отрицательному электроду (катоду). Анионы движутся по направлению к положительно заряженному электроду (аноду). Электрическое поле не оказывает влияния на незаряженные молекулы. При использовании проницаемых для ионов неселективных мембран можно разделять электролиты и неэлектролиты. Применяя катионообменные или анионообменные мембраны, при помощью электродиализа можно повысить или понизить концентрацию раствора электролита. Матрица анионообменной мембраны имеет катионные группы. Заряд катионов нейтрализован зарядом подвижных анионов, находящихся в порах мембраны. Анионы раствора электролита могут внедряться в матрицу мембраны и замещать первоначально присутствующие в ней анионы. Проникновению в мембрану катионов препятствуют силы отталкивания их фиксированными в матрице мембраны катионами. Аналогичным образом действуют и катионообменные мембраны, содержащие фиксированные анионные группы. В многокамерном электродиализаторе чередуется большое число (до нескольких сотен) катионообменных и анионообменных мембран, расположенных между двумя электродами Рис. 1. Электрический ток переносит катионы из исходного раствора в поток концентрата через катионообменную мембрану, расположенную со стороны катода. Катионы задерживаются в этом потоке анионообменной мембраной со стороны катода. Направление движения анионов является противоположным. Они переносятся в поток концентрата через анионообменную мембрану. Со стороны анода анионы задерживаются в потоке концентрата катионообменной мембраной. Таким образом, общий результат процесса заключается в увеличении концентрации ионов в чередующихся камерах при одновременном уменьшении их концентрации в других камерах. На электродах протекает процесс электролиза. В многокамерном аппарате неизбежные непроизводительные затраты электроэнергии, обусловленные этим процессом, распределяются на большое число камер. Поэтому в расчете на единицу продукции эти затраты сводятся к минимуму.
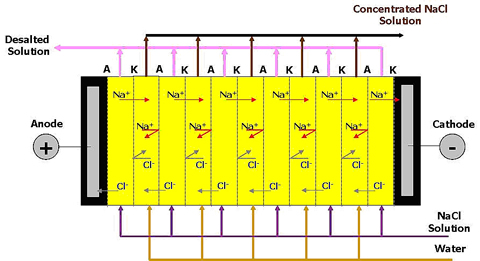
Рис.1. Процесс электродиализа (мембранного электролиза): А - анионообменные мембраны, К - катионообменные мембраны
Ионообменные мембраны, применяемые для электродиализа, должны иметь высокую электропроводность и высокую проницаемость для ионов. Кроме того, они должны обладать высокой селективностью, умеренной степенью набухания и достаточной механической прочностью. Как правило, электрическое сопротивление на единицу поверхности ионообменной мембраны находится в пределах от 2 Ом/см2 до 10 Ом/см2.
В растворе у поверхности мембраны всегда возникает концентрационная поляризация. При электродиализе концентрационная поляризация проявляется в большей степени, чем при баромембранных процессах. Рассмотрим явление концентрационной поляризации у поверхности катионообменной мембраны. При наложении движущей силы – разности потенциалов – катионы будут перемещаться по направлению к катоду. В процессе мембранного электролиза числа переноса ионов в мембранах существенно превосходят числа переноса ионов в растворе, поэтому поток катионов через мембрану, обусловленный разностью потенциалов, превосходит аналогичный поток в растворе. В результате концентрация катионов со стороны катода вблизи поверхности мембраны будет увеличиваться, а со стороны анода – уменьшаться. Это будет происходить до тех пор, пока в растворе со стороны катода и со стороны анода не установятся такие градиенты концентраций, при которых поток катионов в растворе за счет диффузии и за счет разности потенциалов не станет равным потоку катионов через мембрану. Таким образом, у поверхности мембраны концентрация катионов увеличивается со стороны концентрированного раствора и уменьшается со стороны разбавленного раствора. Снижение концентрации со стороны разбавленного раствора ограничивает плотность электрического тока, который может быть использован при электродиализе.
Процесс электродиализа в реже применяется в промышленности, чем процессы обратного осмоса и ультрафильтрации, так как применяя электродиализ возможно удалять из раствора только ионы. Наиболее широко электродиализные установки применяются для опреснения морской воды при получении питьевой и/или технической воды. Но чаще процесс электродиализа применяют для очистки воды, содержание растворенных солей в которой составляет примерно 10 г/л. В этом случае процесс электродиализа является более экономичным по сравнению с обратным осмосом или выпариванием. При помощи электродиализа можно получать растворы солей со сравнительно высокой концентрацией. Благодаря этой особенности рассматриваемого процесса электродиализ применяется также при производстве поваренной соли и других солей из морской воды. Электродиализ применяется также для предочистки воды для теплоэнергетических установок.
Важное направление использования электродиализных установок - очистка сточных вод. Электродиализ применяется для обессоливания сточных вод гальванического производств (гальванических стоков). Также мембранный электролиз используется для концентрирования сточных вод, содержащих ценные компоненты (например, драгоценные металлы), перед последующим извлечением этих компонентов. По сравнению с обратным осмосом электродиализ имеет то преимущество, что позволяет использовать термически и химически более стойкие мембраны, поэтому процесс электродиализа может осуществляться при повышенных температурах, а также при очень малых или наоборот больших значениях pH раствора. Ограничением в применении электродиализа для очистки стоков гальванического производства является невозможность удалить незаряженные компоненты, которые также присутствуют в сточных водах
Испольэование электродиализа:
• производство питьевой воды из морской и брохической вод
• очистка солей осаженных рудниковых вод
• производство концентрата NaCl из морской воды
• отделение органических и анорганических кислот, очистка органических кислот, очистка аминокислот и т.п. в химической промышленности
• очистка серумов, вакцин, витаминов, протеинов и энзимов в фармацевтической промышленности
• регенерация и рециркуляция гальванической ванны
• очистка отходящих вод или рециркуляция химических веществ на химических и бумажных заводах
Очистка воды электродиализом
Диализ (греч. dialysis – разделение) – физический процесс диффузии через полупроницаемые мембраны ионов загрязнений из зоны больших в зоны меньших концентраций. Движущей силой диализа является разность концентраций по обе стороны перегородки, а коэффициент диализа (коэффициент массообмена), имеющий размерность скорости, определяется экспериментально.
Электродиализ заключается в разделении воды и содержащихся в ней ионных примесей в поле постоянного электрического тока. Ионы – поляризованные частицы и, как отмечалось, в электрическом поле они перемещаются в соответствии со знаками своих зарядов: к отрицательно заряженному катоду (катионы) и к положительно заряженному аноду (анионы).
Скорость движения ионов, главных переносчиков тока (в этом процессе так же участвуют коллоиды и другие крупные поляризованные частицы), зависит от их
подвижности и от электропроводности воды.
В табл. 5.3 приводятся значения подвижности некоторых ионов и их радиусов в гидратированном состоянии.
Электродиализ применяется для обессоливания природных (например, морских) вод, при очистке производственных стоков, а так же с целью утилизации кислот и щелочей. Солесодержание очищаемой воды может составлять несколько г-экв/л.
Электродиализом удаляются только ионы, а недиссоциированные молекулы, коллоиды и ГДП остаются в очищенной воде.
Таблица 5.3
Подвижность некоторых ионов
|
Ион |
Подвижность при +25 °С |
Радиус иона, нм |
|
H+ |
349,7 |
1,54 |
|
Na + |
50,1 |
0,98 |
|
K + |
73,5 |
1,33 |
|
½ Mg2+ |
53,06 |
0,78 |
|
½ Ca2+ |
59,5 |
1,06 |
|
Al 3+ |
63,0 |
0,57 |
|
OH – |
197,6 |
1,53 |
|
C l– |
73,32 |
0,26 |
|
SO 4 2– |
79,8 |
2,30 |
|
HCO 3 – |
44,5 |
– |
|
На рис. 5.18 приведена принципиальная схема электродиализера. Аппарат состоит из нескольких разделенных ионитовыми мембранами камер, образующих ячейки. Каждая ячейка включает диализную и смежные с ней рассольную или электродную камеры. Ширина камер (расстояние между диафрагмами) 1…2 мм. Ионитовые (катионовые и анионовые) мембраны толщиной менее 1 мм изготавливаются из порошков ионообменных смол и полимерного вяжущего. Поскольку каркас катионитовой мембраны заряжен отрицательно, а анионитовой – положительно, первые пропускают только катионы и отталкивают анионы, а вторые, наоборот, пропускают анионы и отталкивают катионы. В [74] указывается на применимость мембран, пленочный слой которых заряжается и несет положительный или отрицательный заряды, что обеспечивает их селективность. При положительном заряде слоя он пропускает только катионы и задерживает анионы, при отрицательном – пропускает анионы и задерживает катионы. При создании разности потенциалов и прохождении через воду, являющуюся проводником второго рода, постоянного электрического тока, начинается направленное движение ионов. Ионы, попавшие в рассольные камеры, окажутся в них «запертыми», а в электродных камерах будет происходить деполяризация (разрядка) ионов. В результате электродных реакций выделяются газы и образуются осадки гидроксидовметаллов, кислоты и щелочи (см. гл. 7). Из камер очищенной воды (диализата) и рассольных камер раздельно отводят очищенную воду и рассол, концентрация которого ограничивается условиями кристаллизации. |
Таким образом, при электродиализе ионы вынужденно перемещаются из области низких в область высоких концентраций, что противоречит закономерности природного процесса диализа.
Очистка будет происходить при обязательном условии преодоления действия диализа.
Работа электродиализных установок усложняется явлением концентрационной поляризации, при которой содержание ионов вблизи мембран в диализных камерах резко снижается, иногда до нуля. Это объясняется тем, что скорость переноса ионов через мембрану превышает их скорость в растворе.
В результате электрическое сопротивление увеличивается, а диссоциация молекул воды и перенос протонов и гидроксид-ионов через мембраны приводит к подщелачиванию рассола и подкислению очищенной воды [74].
Кинетика процесса описывается уравнением
 ,
,
где Icur – сила тока, А; Ф – число Фарадея, затрата электричества на перенос 1 г‑экв.солей; KД – коэффициент диализа, см/ч; Fм – площадь мембран, см2; DС – перепад концентраций ионов по обе стороны мембраны, г-экв/см3; W – объем ячейки, см3.
Формула учитывает одновременность взаимно противодействующих процессов электродиализа и диализа.
После интегрирования уравнения от Сen до Сex можно получить формулу для определения продолжительности процесса очистки, ч:
 , (5.15)
, (5.15)
где DСen и DСex – перепад концентрации ионов по обе стороны мембраны в начале и в конце процесса.
Сила тока, необходимая для очистки, определяется из закона Фарадея
 , (5.16)
, (5.16)
где qw – расчетный расход воды, м3/ч; h – выход по току, значения которого зависят от Сex (табл. 5.4.).
Таблица 5.4
Ориентировочные значения выхода по току [132]
|
Cex , г-экв/л |
0,01 |
0,02 |
0,05 |
0,10 |
0,20 |
0,50 |
|
h |
0,89 |
0,88 |
0,86 |
0,84 |
0,825 |
0,80 |
Таким образом, при увеличении Cex выход по току уменьшается.
Площадь мембран (анионовых и катионовых)
 , (5.17)
, (5.17)
где iel – расчетная плотность тока, А/м2.
Увеличение плотности тока возможно с учетом следующих ограничений технологического и эксплуатационного характера: усиливается диссоциация молекул воды, что приводит к изменению pH воды и к образованию трудноудаляемых осадков; увеличиваются тепловыделения; могут возикнуть повреждения мембран.
Оптимизация значений плотности тока, зависящая от вида мембран и от качества воды, должна производиться с учетом опытно-эксплуатационных данных. Можно заметить, что с увеличением концентрации солей в воде оптимальные плотности тока возрастают, достигая 50…130 А/м2.
Напряжение на электродах аппарата, В,
U = Uэ + n Eм (1+iel rя),(5.18)
где Uэ = 3¼5 – падение напряжения на электродах, В; n – количество последовательно соединенных ячеек, шт.; Eм = f(T°; Cp /Cд) – мембранный потенциал ячейки, T° – температура; Cp и Cд – концентрации солей в рассоле и диализате); rя – омическое сопротивление в ячейке.
На основании формул (5.17) и (5.18) количество ячеек в аппарате
 (5.19)
(5.19)
Электролизаторы выполняются по нескольким схемам: прямоточной, при которой вода последовательно или параллельно проходит через ячейки, и ее очистка осуществляется в один проход (рис. 5.19, а и 5.19, б); циркуляционной порционной, при которой вода многократно проходит через аппарат до тех пор, пока не будет достигнута требуемая степень очистки (рис. 5.20, а); циркуляционной непрерывного действия, по которой часть очищенной воды подмешивается к неочищенной воде и вновь поступает в аппарат (рис. 5.20, б). Каждая из схем имеет оптимальную область применения.
|
|
Прямоточная система рекомендуется при больших производительностях электродиализной установки (ЭДУ). В этой схеме степень очистки зависит только от
продолжительности пребывания воды в ячейках. Недостаток схемы заключается в чувствительности к колебаниям качества исходной воды. Порционные схемы
ЭДУ легко регулируются при колебаниях качества воды за счет изменения режима рециркуляции. Их недостаток – в большей энергоемкости, в сравнении с предыдущей
схемой (рис. 5.20).
Схема с постоянной циркуляцией устойчиво работает при любом солесодержании исходной воды и обеспечивает непрерывную ее обработку. Разбавление исходной воды диализатом снижает опасность концентрационной поляризации. Во избежание засорения камер ЭДУ исходная вода нуждается в предварительной подготовке: содержание взвешенных веществ ограничивается 1,0…1,5 мг/л, железа и марганца – 0,05 мг/л для каждого, жесткости общей – 40 мг‑экв/л. Работа ЭДУ сопровождается выделением газов, в частности, водорода и кислорода, способных образовать взрывоопасную смесь (гремучий газ); опасность представляет и возможное выделение хлора. Поэтому ЭДУ выполняются герметизированными, а помещения должны оборудоваться средствами автоматизированного контроля за состоянием воздушной среды и вентиляцией. Во избежание засорения отложениями корректируется pH воды, а кон центрация образующегося рассола ограничивается с тем, чтобы исключить опасность кристаллизации.
|
|
Степень очистки от ионов электродиализом ограничивается технико-экономическими соображениями. По мере повышения концентрации ионов в рассольных камерах, в них усиливается осмотическое давление и тенденция к возврату через диафрагмы вдиализные камеры. Повышение напряжения с целью ограничить эту тенденцию удорожает эксплуатацию установки. В [74] рекомендуется применять электродиализ при солесодержании в исходной воде не свыше 2 г/л и ограничить солесодержание в очищенной воде, как максимум, 200 мг/л.
ДЕСТРУКТИВНАЯ ОЧИСТКА.
Деструктивная очистка позволяет изменить состав водных примесей таким образом, что они либо перестают быть загрязнениями, либо легко удаляются из воды регенеративными методами.
Различают химическую, электрохимическую и биохимическую очистку. При различии технологических схем, конструкций установок, условий все эти способы основаны на общих химических закономерностях.
Следует отметить следующие особенности деструктивной очистки:
– ее эффективность увеличивается с возрастанием дисперсности частиц примесей, и она применяется преимущественно при удалении молекулярных и ионных загрязнений;
– деструктивный процесс носит затухающий характер, что заставляет ограничивать эффект очистки допустимой продолжительностью обработки воды;
– по ходу очистки могут образовываться промежуточные продукты, иногда более опасные, чем исходные загрязнения;
– процесс очистки ограничен многими физическими и химическими условиями и необходима оптимизация влияния последних.
В многоступенчатых схемах улучшения качества воды приемы деструкции и регенерации часто сочетаются. Так, в схеме очистки городских сточных вод, наряду с механической (регенеративной) очисткой, применяется биологическая (деструктивная) очистка.
В случаях, когда для удаления тех или иных загрязнений применимы и деструктивная и регенеративная очистка, выбор обосновывается технико-экономическими расчетами.



